Pour plus de clarté, les publications récentes de cet article sont discutées dans le contexte des principales études cliniques qui les ont précédées et qui ont influencé la prescription de THS au Royaume-Uni. Il s'agit de la réanalyse de 1997 du CGHFBC de 51 études observationnelles mondiales, des publications antérieures de l'étude randomisée WHI, de l'étude observationnelle Million Women's Study (MWS) et de la Menopause Guidance (NG23) de 2015 de l'Institut national britannique pour la santé, les soins et l'excellence.
- L'étude CGHFBC de 1997 a établi une association durée-dépendante du THS avec le risque de diagnostic, apparaissant après 5 ans d'exposition (un rapport de risque global de 1,35). Cette association semblait plus importante avec un THS combiné qu'avec un THS non opposé et diminuait après l'arrêt du traitement (1)
- En 2002 et 2004, les premiers résultats de l'étude WHI randomisée et contrôlée par placebo ont confirmé une augmentation globale du risque de signification limite avec le THS combiné continu (c'est-à-dire 0,625 mg d'œstrogènes conjugués équins [OCE] plus 2,5 mg d'acétate de médroxyprogestérone [MPA]) (2) (3).
- En 2003, l'étude observationnelle MWS a signalé une augmentation du risque de cancer du sein avec tous les schémas de THS, l'augmentation la plus importante du risque étant associée aux préparations combinées. Contrairement à toutes les autres études, l'impact du THS a été observé avec un risque d'utilisation à court terme (c'est-à-dire de 6 mois à moins de 2 ans). Ce résultat erroné a été attribué à un biais de constatation et à une sous-estimation de la durée d'exposition au THS, mais la publicité négative que les résultats ont suscitée a entraîné une baisse significative de la prescription de THS dans le monde entier. (4)
Dans l'étude WHI comme dans l'étude MWS, les chercheurs ont mis l'accent sur l'utilisation de rapports de risque et de pourcentages de variation du risque, qui ont été mal interprétés. Ces erreurs auraient pu être évitées si les résultats avaient été présentés en chiffres absolus et encadrés. (5)
- La NG239 de 2015 comprenait une évaluation des résultats à court terme de l'HTS, avec une utilisation jusqu'à 5 ans sur les résultats du cancer du sein. Les études cliniques éligibles à l'examen étaient principalement observationnelles et de qualité faible à modérée dans le meilleur des cas, et dans l'ensemble, les résultats ne différaient pas de manière significative de ceux des preuves précédentes. (6)
Par conséquent, les données cliniques antérieures publications plus récentes ont permis de tirer les conclusions suivantes : (2,3,4)
- Le THS à base d'œstrogènes seuls (CEE, œstradiol, œstriol) a été associé à une modification faible ou nulle du risque et il est possible qu'il ne soit pas augmenté par des œstrogènes vaginaux faiblement dosés.
- Le THS combiné, quelle que soit la voie d'administration, peut être associé à un risque accru, qui semble dépendre de la durée.
- Le risque de diagnostic n'était pas élevé chez les anciennes utilisatrices de THS.
- Le risque était limité aux femmes maigres (c'est-à-dire sans surpoids ni obésité).
- Il ne semble pas y avoir d'effet de dosage avec les œstrogènes.
- Il se peut qu'il n'y ait pas eu d'effet additif chez les femmes présentant un risque personnel élevé en raison d'antécédents familiaux ou d'une affection mammaire bénigne à haut risque.
En août 2019, le Collaborative Group on Hormonal Factors in Breast Cancer (CGHFBC) a publié une méta-analyse portant sur plus de 100 000 femmes ayant reçu un diagnostic de cancer du sein et concernant le type et le moment de l'hormonothérapie ménopausique et le risque de cancer du sein (7). Cette publication a également permis d'estimer les risques relatifs de cancer du sein associés à différentes durées d'exposition et formulations de l'hormonothérapie ménopausique, ainsi qu'un algorithme de modélisation du cancer du sein basé sur l'importance des antécédents familiaux.
En 2020, le rapport sur les résultats à long terme de l'étude randomisée et contrôlée par placebo Women's Health Initiative (WHI) a été publié. (8)
Sur la base de ces éléments, les preuves actuelles sont les suivantes (7,8) :
1. Chez les femmes présentant un faible risque sous-jacent de cancer du sein (c'est-à-dire la majeure partie de la population), les avantages d'un traitement hormonal substitutif d'une durée maximale de 5 ans pour soulager les symptômes sont supérieurs aux inconvénients potentiels :
- L'œstrogène non opposé est associé à un risque nul ou peu modifié, mais l'âge au moment de l'initiation peut influer sur ce résultat.
- Il n'y a pas de preuve d'un effet de dosage avec l'œstrogène.
- Les œstrogènes vaginaux ne sont pas associés à un risque accru.
- Le THS combiné peut être associé à un risque accru, qui semble dépendre de la durée.
- Bien que le risque associé à un THS combiné continu puisse être plus élevé que celui associé à un THS séquentiel, la différence de risque est faible et peut être compensée par une protection contre le cancer de l'endomètre.
- Le fait d'éviter les progestatifs synthétiques dans les préparations combinées peut minimiser le risque.
- Le risque est limité aux femmes maigres
- Le risque associé au THS (y compris les anciennes utilisatrices) est moindre que les autres facteurs de risque de cancer du sein liés au mode de vie.
- Chez les femmes souffrant d'insuffisance ovarienne prématurée, les années d'exposition au THS doivent être comptabilisées à partir de l'âge de 50 ans.
- La communication du risque en termes d'excès de risque absolu avec encadrement minimise les erreurs d'interprétation.
2. Chez les femmes à haut risque ou les survivantes du cancer du sein (7,8) :
- Il n'y a pas d'effet additif de l'exposition au THS chez les femmes présentant un risque personnel élevé en raison d'antécédents familiaux ou d'une affection mammaire bénigne à haut risque.
- Si l'utilisation d'un THS ou d'œstrogènes vaginaux est envisagée, ce ne doit être que pour la prise en charge des symptômes de carence en œstrogènes, après discussion avec l'équipe de spécialistes du sein de la femme.
- Les œstrogènes vaginaux peuvent être utilisés chez les femmes qui prennent du tamoxifène mais pas d'inhibiteurs de l'aromatase.
Le rapport du Collaborative Group on Hormonal Factors in Breast Cancer (CGHFBC) a également montré des différences dans les données concernant les tumeurs à récepteurs d'œstrogènes positifs et négatifs et l'utilisation des MHT (7) :
- chez les utilisatrices actuelles, ces risques excédentaires de cancer du sein étaient certains même au cours des années 1 à 4 (RR œstrogènes-progestatifs 1,60, IC à 95 % 1,52-1,69 ; RR œstrogènes seuls 1,17, 1,10-1,26), et étaient deux fois plus importants au cours des années 5 à 14 (RR œstrogènes-progestatifs 2,08, 2,02-2,15 ; RR œstrogènes seuls 1,33, 1,28-1,37)
- les risques liés aux œstrogènes-progestatifs au cours des années 5 à 14 étaient plus importants en cas d'utilisation quotidienne qu'en cas d'utilisation moins fréquente de progestatifs (RR 2,30, 2,21-2,40 vs 1,93, 1,84-2,01 ; hétérogénéité p<0,0001)
- pour une préparation donnée, les RR au cours des années 5 à 14 d'utilisation courante étaient beaucoup plus élevés pour les tumeurs à récepteurs d'œstrogènes positifs que pour les tumeurs à récepteurs d'œstrogènes négatifs, étaient similaires pour les femmes commençant l'HTA à 40-44 ans, 45-49 ans, 50-54 ans et 55-59 ans, et étaient atténués par le fait de commencer après 60 ans ou par l'adiposité (le risque lié à l'HTA à base d'œstrogènes seuls étant faible chez les femmes obèses)
- après l'arrêt de l'HTA, un certain excès de risque persistait pendant plus de 10 ans ; son ampleur dépendait de la durée de l'utilisation antérieure, l'excès étant faible après moins d'un an d'utilisation de l'HTA.
En 2019, la MHRA a déclaré (9) :
Au Royaume-Uni, environ 1 femme sur 16 qui n'utilise jamais de THS reçoit un diagnostic de cancer du sein entre 50 et 69 ans. Cela équivaut à 63 cas de cancer du sein pour 1000 femmes. Au cours de la même période (50-69 ans), avec 5 ans d'utilisation d'un THS, l'étude a estimé :
- environ 5 cas supplémentaires de cancer du sein pour 1000 femmes utilisant un THS à base d'œstrogènes seuls
- environ 14 cas supplémentaires de cancer du sein pour 1000 femmes utilisant des œstrogènes combinés à des progestatifs pendant une partie du mois (THS séquentiel)
- environ 20 cas supplémentaires de cancer du sein pour 1000 femmes utilisant des œstrogènes combinés à un progestatif quotidien (THS continu).
Ces risques s'appliquent à une période de 5 ans d'utilisation du THS. Le nombre de cas supplémentaires de cancer du sein susmentionnés doublerait approximativement si le THS était utilisé pendant 10 ans au lieu de 5.
La MHRA a également déclaré (9) :
- Toutes les formes de THS systémique sont associées à une incidence excessive significative de cancer du sein, quel que soit le type d'œstrogène ou de progestatif ou la voie d'administration (orale ou transdermique)
- L'utilisation actuelle ou antérieure d'un THS pendant moins d'un an n'entraîne que peu ou pas d'augmentation du risque ; en revanche, l'utilisation d'un THS pendant plus d'un an entraîne une augmentation du risque.
- Le risque de cancer du sein augmente encore avec la durée d'utilisation du THS.
- Le risque de cancer du sein est plus faible après l'arrêt du THS qu'il ne l'est pendant l'utilisation actuelle, mais reste plus élevé chez les anciennes utilisatrices de THS pendant plus de 10 ans que chez les femmes qui n'ont jamais utilisé de THS.
- Le risque de cancer du sein est plus élevé pour les THS combinés œstroprogestatifs que pour les THS à base d'œstrogènes seuls.
- Pour les femmes qui utilisent un THS pendant des durées similaires, le nombre total de cancers du sein liés au THS à l'âge de 69 ans est similaire, que le THS ait été commencé dans la quarantaine ou dans la cinquantaine.
- L'étude n'a pas mis en évidence d'effet sur le risque de cancer du sein de l'utilisation de faibles doses d'œstrogènes appliquées directement par le vagin pour traiter des symptômes locaux.
La MHRA a résumé les risques du THS en ce qui concerne le cancer du sein, de l'endomètre et de l'ovaire (9) :
Résumé des risques et des avantages du THS* pendant l'utilisation actuelle et l'utilisation actuelle plus le post-traitement à partir de l'âge de la ménopause jusqu'à l'âge de 69 ans, pour 1000 femmes ayant utilisé le THS pendant 5 ans ou 10 ans (9).
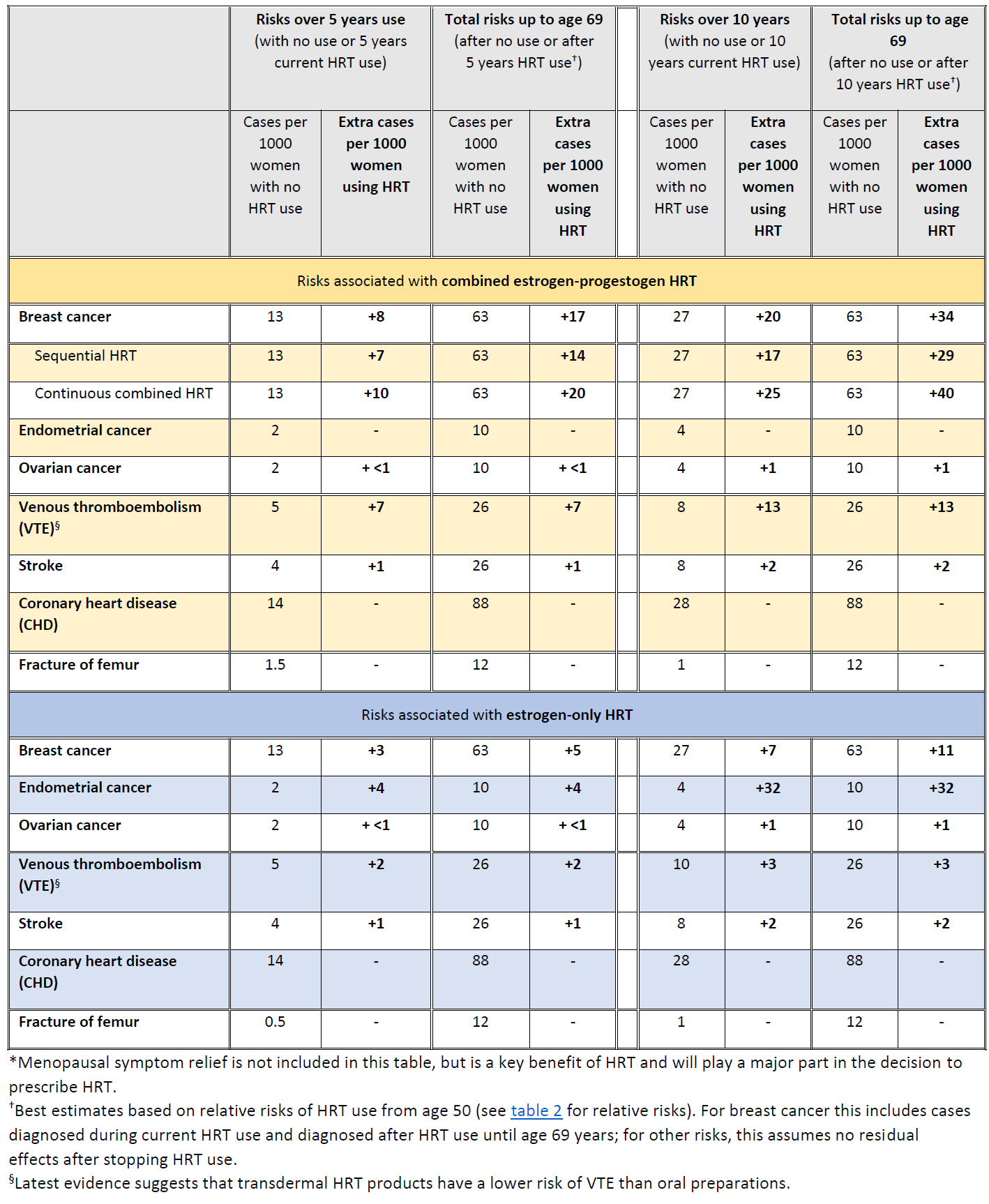
En 2020, une étude a été menée sur 98 611 femmes âgées de 50 à 79 ans ayant reçu un diagnostic primaire de cancer du sein entre 1998 et 2018, appariées selon l'âge, la pratique générale et la date de l'indice à 457 498 femmes témoins (10). L'étude a révélé que l'utilisation passée à long terme d'une thérapie à base d'œstrogènes seuls et l'utilisation passée à court terme (<5 ans) d'œstrogènes-progestatifs n'étaient pas associées à un risque accru.
Une alerte du NIHR relative à cette étude indique que (10) :
- La plupart des femmes ont pris un THS combiné, qui a été associé à une légère augmentation du risque de cancer du sein. Le risque augmentait avec :
- l'âge de la femme, avec des augmentations de risque plus faibles pour les femmes dans la cinquantaine que pour celles dans la soixantaine et la septantaine
- la durée du traitement, l'augmentation du risque étant plus faible lorsque le THS est pris à court terme (moins de 5 ans) qu'à long terme (plus de 5 ans)
- le traitement hormonal substitutif actuel ou plus récent, qui comportait des risques plus élevés que l'utilisation antérieure (il y a plus de 5 ans)
- le type de progestatif utilisé dans le cadre d'un THS combiné, les risques les plus élevés étant associés à la noréthistérone et les plus faibles à la dydrogestérone.
- Les chercheurs ont souligné que certaines femmes n'ayant jamais pris de THS pouvaient quand même développer un cancer du sein. Par exemple, si un groupe de 10.000 femmes dans la cinquantaine n'avait jamais pris de THS, 26 femmes seraient quand même atteintes d'un cancer du sein en un an. Si les 10 000 femmes avaient récemment pris un THS combiné pendant moins de 5 ans, 35 d'entre elles seraient atteintes d'un cancer du sein. Ainsi, dans ce grand groupe de femmes, le THS est lié à 9 cas supplémentaires de cancer du sein en un an. Cela représente moins d'une femme sur mille.
- L'augmentation du risque était principalement liée au THS combiné, et le type de progestatif faisait une différence. Le risque augmente de façon similaire lorsque des préparations contenant certains types de progestatifs (noréthistérone, lévonorgestrel ou médroxyprogestérone) sont prises pendant plus d'un an. L'augmentation du risque la plus faible a été observée avec la dydrogestérone (un autre type de progestatif).
- Même si les femmes prenaient un THS combiné à long terme (plus de 5 ans), les risques diminuaient après l'arrêt du traitement. Pour les femmes dans la cinquantaine, il n'y avait pas de risque supplémentaire de cancer du sein avec un THS combiné qui avait été arrêté plus de 5 ans auparavant. Il y avait peu de risque supplémentaire chez les femmes de 60 et 70 ans.
- Il n'y a pas eu d'augmentation du risque de cancer du sein :
- avec tout THS actuel pris pendant un an ou moins
- en cas d'utilisation antérieure d'un THS à base d'œstrogènes seuls, même s'il a été pris à long terme
- en cas d'utilisation antérieure d'un THS combiné pris sur une courte durée
Risque de cancer du sein en cas d'antécédents familiaux de cancer du sein (11)
- Une étude de modélisation menée au Royaume-Uni en 2024 a révélé que pour une femme ayant des antécédents familiaux "moyens" et ne prenant pas de THM, le risque cumulé de cancer du sein (entre 50 et 80 ans) est de 9,8 % et le risque de mourir d'un cancer du sein est de 1,7 %.
- Dans ce modèle, on a calculé qu'une exposition de 5 ans à une HTA cyclique combinée (50-55 ans) augmentait ces risques à 11,0 % et 1,8 %, respectivement.
- Pour une femme ayant des antécédents familiaux "forts" et ne prenant pas de MHT, le risque cumulé de cancer du sein est de 19,6 % (50-80 ans) et le risque de mourir d'un cancer du sein est de 3,2 %. Avec une exposition de 5 ans au MHT (50-55 ans), ce modèle a montré que ces risques augmentent respectivement de 22,4 % et de 3,5 %. (11)
- par exemple, pour une femme "moyenne" de 51 ans suivant un THS combiné pendant 5 ans, la probabilité de développer un cancer du sein attribuable au THS est de 1 sur 67
- pour celles qui ont des antécédents familiaux importants, la probabilité respective est de 1 sur 30
- les auteurs concluent que, bien que les personnes ayant des antécédents familiaux importants de cancer du sein aient un risque de base considérablement accru de développer un cancer du sein, la majeure partie de l'incidence du cancer du sein et de la mortalité pour ce groupe sera attribuable à leur risque de base plutôt qu'à l'ajout d'un THS pris à l'âge de 50 ans.
- par exemple, pour une femme "moyenne" de 51 ans suivant un THS combiné pendant 5 ans, la probabilité de développer un cancer du sein attribuable au THS est de 1 sur 67
Remarque :
Tout risque de cancer du sein doit être considéré dans le contexte de l'ensemble des bénéfices et des risques associés à la prise d'un traitement hormonal de la ménopause (THM), y compris le contrôle des symptômes de la ménopause, l'amélioration de la qualité de vie et l'impact à long terme sur la santé osseuse et cardiovasculaire. La décision de prendre ou non de l'hormonothérapie ménopausique, la dose d'hormonothérapie ménopausique et la durée de son utilisation doivent être prises sur une base individuelle après avoir discuté des avantages et des risques avec les femmes pour les aider à faire un choix éclairé concernant leur santé et les soins qu'elles reçoivent.
Référence :
- Groupe de collaboration sur les facteurs hormonaux du cancer du sein. Cancer du sein et traitement hormonal substitutif : Collaborative reanalysis from 51 individual epidemiological studies. Lancet 1997 ; 350 : 1047-1060
- Groupe de rédaction des enquêteurs de la Women's Health Initiative. Risques et avantages de l'association œstrogène-progestatif chez les femmes ménopausées en bonne santé. JAMA 2002 ; 288 : 321- 333
- Anderson GL, Limacher M, Assaf AR et al ; Womens's Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy : The Women's Health Initiative randomized controlled trial. JAMA, 2004 ; 291 : 1701-12
- Collaborateurs de l'étude Million Women. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 2003 ; 362 : 419-427
- Gigerenzer G. How innumeracy can be exploited, In Reckoning with Risk, publishers Penguin Group, 2003.
- National Institute for Health and Care Excellence ; Menopause ; Clinical Guideline - methods, evidence and recommendations (NG23), 2015 www.nice.org.uk/guidance/ ng23
- Groupe de collaboration sur les facteurs hormonaux du cancer du sein. Type and timing of menopausal hormone therapy and breast cancer risk : individual participant meta-analysis of the worldwide epidemiological evidence, doi.org/10.1016/S0140- 6736(19)31709-X
- Chlebowski RT, Anderson GL, Aragaki AK et al. Association of menopausal hormone replacement therapy with breast cancer incidence and mortality during long-term follow-up of the Women's Health Initiative randomised clinical trials (Association du traitement hormonal substitutif de la ménopause avec l'incidence du cancer du sein et la mortalité au cours du suivi à long terme des essais cliniques randomisés de la Women's Health Initiative). JAMA, 2020 ; 324 : 369-380.
- MHRA (août 2019). Traitement hormonal substitutif et risque de cancer du sein.
- Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of breast cancer : nested case-control studies using the QResearch and CPRD databases. BMJ 2020;371:m3873.
- Huntley C et al. Breast cancer risk assessment for prescription of Menopausal Hormone Therapy in women who have a family history of breast cancer. British Journal of General Practice 9 mai 2024.
Pages connexes
- Traitement hormonal substitutif (THS) chez les patientes atteintes d'un cancer du sein
- Cancer du sein
- Traitement hormonal substitutif
- Tibolone
- Maladies cardiaques et THS
- Risque de cancer en cas d'arrêt du THS
- Indications cliniques pour le THS (traitement hormonal de substitution)
- Conseils du NICE - THS et risque de cancer du sein
- Examen des preuves concernant le risque de cancer du sein et le THS
Créer un compte pour ajouter des annotations aux pages
Ajoutez à cette page des informations qu'il serait utile d'avoir à portée de main lors d'une consultation, telles qu'une adresse web ou un numéro de téléphone. Ces informations seront toujours affichées lorsque vous visiterez cette page.