Hasta el 10% de los cánceres de mama en los países occidentales se deben a una predisposición genética. La susceptibilidad al cáncer de mama parece heredarse de forma autosómica dominante con penetrancia limitada y, por tanto, puede heredarse del padre o de la madre. Alrededor del 5% de los cánceres de mama se deben a genes dominantes de alta penetrancia.
Se cree que hay más de cinco genes implicados. El más importante parece ser el gen BRCA1, situado en el cromosoma 17q. Recientemente se ha clonado y se cree que presenta mutaciones en diferentes regiones. Otros genes identificados son el BRCA2 en 13q y el gen p53 en 17p.
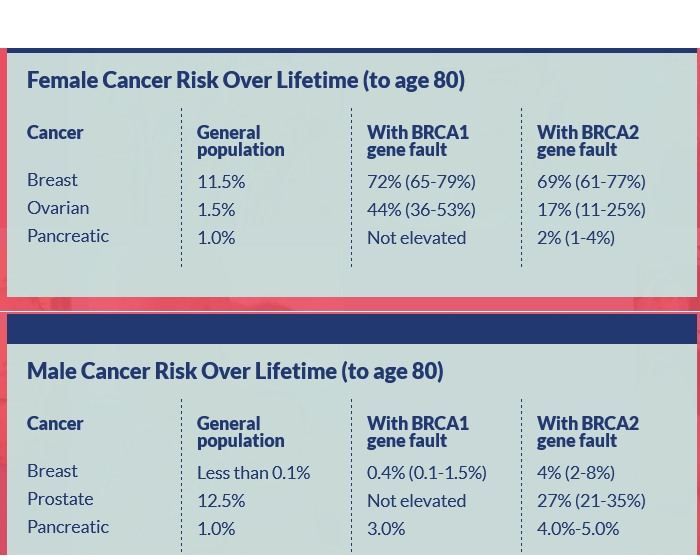
- Las portadoras de BRCA1 tienen un riesgo de por vida cercano al 80% de desarrollar cáncer de mama y un mayor riesgo de cáncer de ovario (40-60%) (1)
- BRCA2 confiere un riesgo menor de cáncer de ovario (20-30%), pero se asocia a un mayor riesgo de padecer otros tipos de cáncer, como cáncer de próstata, cáncer de páncreas y cáncer de mama masculino.
- en la población caucásica general del Reino Unido, la frecuencia de mutaciones en BRCA1 o BRCA2 es de aproximadamente 1/400; en la población asquenazí, la frecuencia de estas mutaciones es de aproximadamente el 2% (1)
- el tratamiento de los cánceres de mama en las portadoras de BRCA1 y BRCA2 es actualmente el mismo que para los casos esporádicos, con la salvedad de que puede ofrecerse una mastectomía bilateral en el momento de la cirugía primaria debido al mayor riesgo de desarrollo de cáncer de mama en la mama contralateral (aproximadamente un 4% al año) (1)
Las características del cáncer de mama familiar incluyen
- edad temprana de presentación
- afectación de varios parientes
- la afectación bilateral es frecuente
- antecedentes de cánceres relacionados: colorrectal, ovario, endometrio
Si un familiar de primer grado padece carcinoma de mama, el riesgo relativo de desarrollarlo es de 1,7 a 2,5. Si un familiar de segundo grado está afectado, el riesgo relativo es de 1,5.
Las pruebas de ADN son posibles para unas pocas familias adecuadas.
Las mutaciones en el gen CHEK2 pueden multiplicar por dos el riesgo de cáncer de mama (1).
Las mutaciones en el gen TP53 aumentan el riesgo de un amplio espectro de tumores, incluidos sarcomas, carcinomas corticosuprarrenales, cáncer cerebral y cáncer de mama de aparición muy temprana.
NICE sugiere (4):
- Probabilidad de portadores a partir de la cual debe ofrecerse la prueba genética
- Cuando esté disponible en atención secundaria, utilizar un método de cálculo de la probabilidad de portador con un rendimiento aceptable demostrado (en calibración y discriminación), así como los antecedentes familiares, para determinar a quién debe ofrecerse la derivación a una clínica genética especializada. Algunos ejemplos de métodos aceptables son BOADICEA y el sistema de puntuación de Manchester
- ofrecer pruebas genéticas en clínicas genéticas especializadas a un familiar con antecedentes personales de cáncer de mama y/o de ovario si dicho familiar tiene una probabilidad combinada de ser portador de mutaciones BRCA1 y BRCA2 igual o superior al 10%.
- ofrecer pruebas genéticas en clínicas genéticas especializadas a una persona sin antecedentes personales de cáncer de mama u ovario si su probabilidad combinada de ser portador de las mutaciones BRCA1 y BRCA2 es igual o superior al 10% y no se dispone de un familiar afectado para la prueba
- Categoría de riesgo de cáncer de mama
Riesgo casi poblacional | Riesgo moderado | Riesgo alto | |
Riesgo a lo largo de la vida a partir de los 20 años | Inferior al 17 | Superior al 17% pero inferior al 30% | 30% o superior |
Riesgo entre los 40 y los 50 años | Menos del 3 | 3-8% | Superior al 8 |
*Este grupo incluye mutaciones conocidas de BRCA1, BRCA2 y TP53 y afecciones raras que conllevan un mayor riesgo de cáncer de mama, como el síndrome de Peutz-Jegher (STK11), Cowden (PTEN) y el cáncer gástrico difuso familiar (E-Cadherina)
- Vigilancia de mujeres sin antecedentes personales de cáncer de mama
- Ofrecer vigilancia mamográfica anual a las mujeres
- de 40-49 años con riesgo moderado de cáncer de mama
- de 40-59 años con alto riesgo de cáncer de mama pero con una probabilidad del 30% o inferior de ser portadoras de BRCA o TP53
- de 40 a 59 años que no se hayan sometido a pruebas genéticas pero tengan una probabilidad superior al 30% de ser portadoras de BRCA
- de 40 a 69 años con una mutación BRCA1 o BRCA2 conocida
- Ofrecer vigilancia anual mediante IRM a las mujeres
- de 30 a 49 años que no se hayan sometido a pruebas genéticas pero tengan una probabilidad superior al 30% de ser portadoras de BRCA
- de 30 a 49 años con una mutación BRCA1 o BRCA2 conocida
- de 20 a 49 años que no se hayan sometido a pruebas genéticas pero tengan una probabilidad superior al 30% de ser portadoras de TP53
- de 20 a 49 años con una mutación TP53 conocida
- Ofrecer vigilancia mamográfica anual a las mujeres
- Vigilancia de las mujeres con antecedentes personales y familiares de cáncer de mama
- ofrecer vigilancia mamográfica anual a todas las mujeres de 50-69 años con antecedentes personales de cáncer de mama que:
- sigan teniendo un riesgo elevado de cáncer de mama (incluidas las que tengan una mutación BRCA1 o BRCA2), y
- no tengan una mutación TP53
- ofrecer vigilancia anual mediante IRM a todas las mujeres de 30 a 49 años con antecedentes personales de cáncer de mama que sigan teniendo un riesgo elevado de padecerlo, incluidas las que tengan una mutación BRCA1 o BRCA2
- ofrecer vigilancia mamográfica anual a todas las mujeres de 50-69 años con antecedentes personales de cáncer de mama que:
- Quimioprevención para mujeres sin antecedentes personales de cáncer de mama
- ofrecer tamoxifeno o raloxifeno durante 5 años a mujeres posmenopáusicas con útero y alto riesgo de cáncer de mama, a menos que tengan antecedentes o puedan tener un mayor riesgo de enfermedad tromboembólica o cáncer de endometrio
- ofrecer tamoxifeno o raloxifeno durante 5 años a mujeres posmenopáusicas con útero y alto riesgo de cáncer de mama, a menos que tengan antecedentes o puedan tener un mayor riesgo de enfermedad tromboembólica o cáncer de endometrio
- mastectomía reductora del riesgo para mujeres sin antecedentes personales de cáncer de mama
- todas las mujeres que se planteen someterse a una mastectomía bilateral reductora del riesgo deben poder comentar sus opciones de reconstrucción mamaria (inmediata y diferida) con un miembro de un equipo quirúrgico con conocimientos especializados en oncoplastia o reconstrucción mamaria
Riesgo de cáncer de mama si hay antecedentes familiares
- Un estudio de modelos del Reino Unido descubrió que el riesgo acumulado de cáncer de mama para las mujeres con antecedentes familiares "medios" que no toman THS es del 9,8%, y aumenta al 11,0% con 5 años de THS cíclica combinada. Para las mujeres con antecedentes familiares importantes, el riesgo es del 19,6% (sin THS), y aumenta al 22,4% con 5 años de THS (5).
- por ejemplo, para una mujer "media" de 51 años con THS combinada durante 5 años, la probabilidad de desarrollar un cáncer de mama atribuible a la THS es de 1 en 67
- en el caso de las mujeres con antecedentes familiares importantes, la probabilidad respectiva es de 1 en 30
- los autores concluyen que, aunque las personas con antecedentes familiares significativos ("importantes") de cáncer de mama tienen un riesgo basal considerablemente mayor de desarrollar cáncer de mama, la mayor parte de la incidencia y mortalidad por cáncer de mama de este grupo se atribuirá a su riesgo basal y no a la adición de THS a los 50 años.
- por ejemplo, para una mujer "media" de 51 años con THS combinada durante 5 años, la probabilidad de desarrollar un cáncer de mama atribuible a la THS es de 1 en 67
El sitio Programa judío de pruebas BRCA del NHS enumera los distintos tipos de cáncer asociados a BRCA1 y BRACA2:
Referencia:
- Pulse (2005); 65(14):55-60.
- Evans DGR et al. (1994). Cáncer de mama familiar. BMJ; 308:183-7
- McPherson et al. (1994). BMJ;309: 1004
- NICE (junio de 2013). Cáncer de mama familiar - Clasificación y atención de las personas con riesgo de cáncer de mama familiar y manejo del cáncer de mama y riesgos relacionados en personas con antecedentes familiares de cáncer de mama.
- Huntley C et al. Evaluación del riesgo de cáncer de mama para la prescripción de terapia hormonal menopáusica en mujeres que tienen antecedentes familiares de cáncer de mama. British Journal of General Practice 9 de mayo de 2024
Páginas relacionadas
- Cáncer de mama
- Mastectomía profiláctica en pacientes con mutaciones BRCA
- Riesgo de cáncer de ovario en función de los antecedentes familiares
- Criterios de derivación desde atención primaria - si hay antecedentes familiares de cáncer de mama
- Gen TP53
- Quimioprevención si no hay antecedentes personales de cáncer de mama
- Mastectomía si no hay antecedentes personales de cáncer de mama
- Ooforectomía si no hay antecedentes personales de cáncer de mama
Crear una cuenta para añadir anotaciones a la página
Añada a esta página información que sería útil tener a mano durante una consulta, como una dirección web o un número de teléfono. Esta información se mostrará siempre que visite esta página